Princípios de SFC
Princípios de HPLC (5)
6 de outubro de 2020Princípios de SFC (2)
6 de outubro de 2020Princípios de SFC
Princípios de sistemas operados com fluido supercrítico
O que é o estado supercrítico
Em 1822, o físico francês Charles Cagniard de la Tour colocou um líquido e uma pedra em um recipiente de alta pressão, de forma que o líquido fosse aquecido. Foi constatado que um ruído referente à pedra que forçadamente era agitada entre as fases líquida e gasosa cessava após certa condição de pressão em temperatura, indicando a formação de uma fase única no sistema, o estado de fluido supercrítico.
Após a descoberta, extensas pesquisas sobre as propriedades físico químicas dos fluidos supercríticos foram realizadas. Apesar disso, nenhuma aplicação prática foi relatada até 1879, quando Hannay and Hogarth reportaram que os fluidos supercríticos apresentavam excelentes propriedades como solventes, acarretando uma segunda onda de pesquisas.
As substâncias podem estar em estado sólido, líquido ou gasoso, dependendo das condições de pressão e temperatura. A água, por exemplo, é líquida em condições ambiente de temperatura e pressão, porém é transformada em vapor (gás) à 100 ºC ou em gelo (sólido) à 0 ºC, ainda considerando pressão ambiente.
Quando a água é alimentada à um recipiente que é subsequentemente selado e submetido a vácuo, como apresentado na figura 1, observa-se que uma fração do líquido é vaporizada e a outra permanece no estado líquido. Quando a pressão de vapor da água atinge um certo valor, conclui-se que o sistema apresenta taxas iguais de evaporação e condensação. Refere-se à esta condição como pressão de vapor de água saturado, um valor dependente da temperatura do sistema.

Durante o aquecimento do recipiente, a água em estado líquido se expande e evapora, levando a uma redução de densidade. Ao ultrapassar a marca de 374 ºC e 22,06 MPa, observam-se o mesmo valor de densidade tanto para a fase líquida quanto gasosa, de maneira a tornar a distinção entre as fases impossível. Nestas condições, não haverá a formação de “líquido” mesmo com o aumento de pressão. Em outras palavras, trata-se de um gás mais denso.

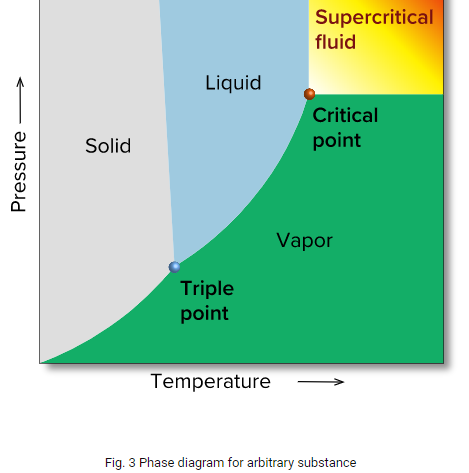
Este estado é conhecido como estado supercrítico. Determina-se como ponto crítico, a condição de temperatura e pressão onde observa-se tal comportamento, neste caso determina-se “pressão crítica” (Pc) e “temperatura crítica” (Tc). A figura 3 apresenta o diagrama de fases de uma substância arbitrária e a tabela 1 apresenta os valores de Tc e Pc de várias substâncias.
| Compound | Critical temperature (℃) | Critical pressure (MPa) |
| NH2 | 132 | 11.28 |
| CO2 | 31 | 7.38 |
| N2O | 36 | 7.24 |
| H2O | 374 | 22.06 |
| C3H8 | 97 | 4.25 |
| C6H14 | 234 | 2.97 |
| CH3OH | 239 | 8.09 |
| C2H5OH | 243 | 6.38 |
| C6H5CH3 | 318 | 4.11 |
A densidade de um fluido supercrítico é mais próxima de líquidos. No entanto, este tipo de substância apresenta viscosidade mais próxima aos gases e coeficiente de difusão intermediário entre os dois estados.
De maneira geral, os fluidos supercríticos apresentam propriedades intermediárias e dependentes de pressão e temperatura, como mostra a tabela 2. Desta forma, fluidos supercríticos podem ser boas ferramentas para trabalhos como solvente (para extração, reações químicas, entre outros) e fase móvel em cromatografia.
| Gas | Critical state | Liquid | |
| Density [kg/cm3] | 1 | 100 – 1000 | 1000 |
| Viscosity [mPa·s] | 0.01 | 0.1 | 1 |
| Diffusion coefficient [m2/s] | 10-5 | 10-5 – 10-8 | 10-10 |
| Thermal conductivity x10-3 [W/(m・K)] | 5 – 30 | 20 – 150 | 50 – 200 |
Referências
C. Cagniard de la Tour, Ann. Chim. Phys. 21, 127 (1822)
J. B. Hannay and J. Hogarth, Proc. R. Soc. London, 29,324 (1879)

